建议收藏:医疗器械法规文件汇编(2020-2023 年版)(文末可下载法规汇编文件)本汇编收集到国家药品监督管理局 2023 年 10 月 31 日前发布的医疗器械监管法规、规章和工作文件。
为更好地贯彻医疗器械法律法规,满足我省医疗器械行业发展需求,广东省药品监督管理局医疗器械监管处收集了医疗器械相关法规、规章和工作文件,汇总成《2020-2023 年医疗器械法规文件汇编》,分为上下二册,上册内容以生产经营使用环节涉及的法规规章工作文件为主,下册内容以研发注册环节涉及的法规规章工作文件为主。

为更好地贯彻医疗器械法律法规,满足我省医疗器械行业发展需求,广东省药品监督管理局医疗器械监管处收集了医疗器械相关法规、规章和工作文件,汇总成《2020-2023 年医疗器械法规文件汇编》,分为上下二册,上册内容以生产经营使用环节涉及的法规规章工作文件为主,下册内容以研发注册环节涉及的法规规章工作文件为主。

境外生产商首先需要指定印度境内的代理持证人,角色包含总代、注册代理等,直接与CDSCO沟通注册等事宜。代理持证公司具体收费(代持证书费用、进口业务费用等)自定。代理持证人必须持有有效的批发许可证(表格20B和21B / 21C)。

据介绍,此次盈康生命的收购标的优尼器械系国内领先的一次性使用高压造影注射器生产制造商,拥有一次性使用高压造影注射器完整产品体系,连续多年获评国家高新技术企业。公司目前拥有一次性使用高压造影注射器及附件、一次性使用压力连接管、一次性使用有创血压传感器三条完整的产品生产线,相关产品在放射科、介入科和ICU及麻醉科室均有应用。产业链生产环节涵盖从清洗、检测、注塑、组装、包装、到灭菌等。

2023年10月,广东省药品监督管理局共批准注册第二类医疗器械产品250个,其中首次注册161个,延续注册89个(具体产品见附件)。

医疗器械PMDA注册是指在日本厚生劳动省进行医疗器械上市前申请的过程。PMDA是日本厚生劳动省的英文缩写,负责监管日本的医疗器械市场,对医疗器械的上市前申请进行审批。


已有1387次查看

已有1233次查看
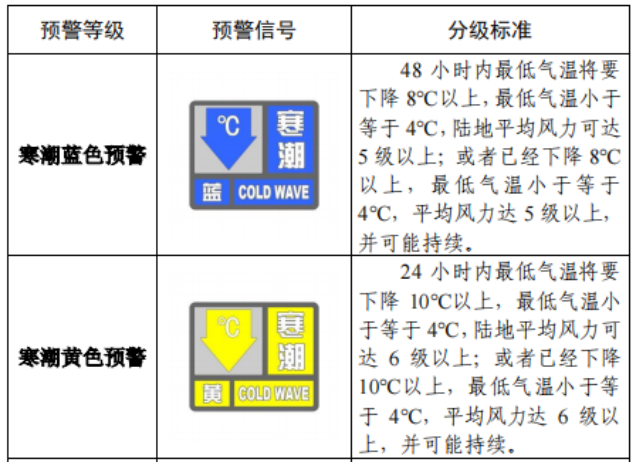
已有1209次查看
已有1190次查看

已有1191次查看

已有1232次查看

已有1237次查看
已有1207次查看
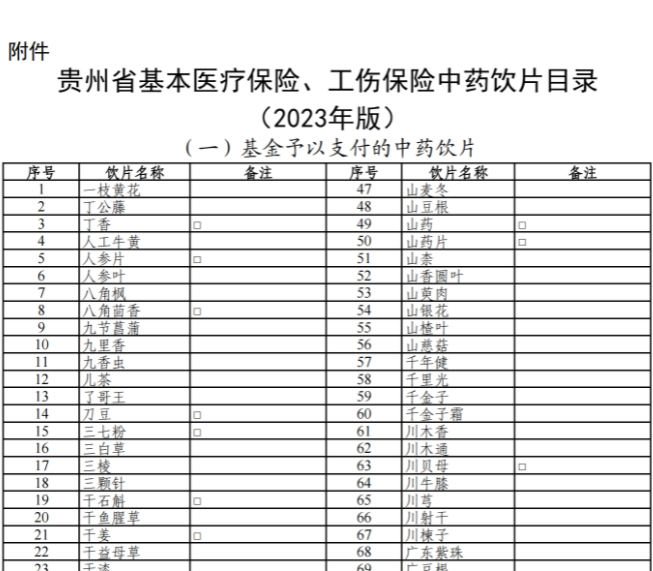
已有1221次查看

已有1131次查看





