北京市第一类医疗器械备案新办北京市药品监督管理局
第十四条 第一类医疗器械产品备案和申请第二类、第三类医疗器械产品注册,应当提交下列资料:
(一)产品风险分析资料;
(二)产品技术要求;
(三)产品检验报告;
(四)临床评价资料;
(五)产品说明书以及标签样稿;
(六)与产品研制、生产有关的质量管理体系文件;
(七)证明产品安全、有效所需的其他资料。
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 福建省 天津市 重庆市 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 台湾省 河南省 湖北省 湖南省 江西省 安徽省 海南省 四川省 贵州省 云南省

第十四条 第一类医疗器械产品备案和申请第二类、第三类医疗器械产品注册,应当提交下列资料:
(一)产品风险分析资料;
(二)产品技术要求;
(三)产品检验报告;
(四)临床评价资料;
(五)产品说明书以及标签样稿;
(六)与产品研制、生产有关的质量管理体系文件;
(七)证明产品安全、有效所需的其他资料。

中华人民共和国国务院令第739号《医疗器械监督管理条例》第十三条 “第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。”
中华人民共和国国务院令第739号《医疗器械监督管理条例》第十五条 “第一类医疗器械产品备案,由备案人向所在地设区的市级人民政府负责药品监督管理的部门提交备案资料。”


已有1725次查看

已有1384次查看

已有1323次查看

已有1348次查看
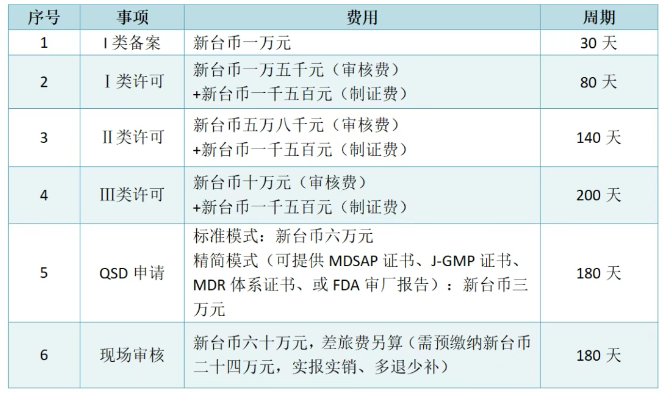
已有717次查看
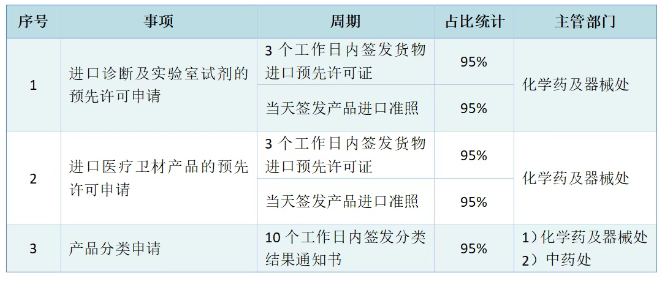
已有586次查看

已有647次查看

已有1005次查看

已有553次查看

已有516次查看

已有654次查看

已有577次查看

已有520次查看

已有594次查看
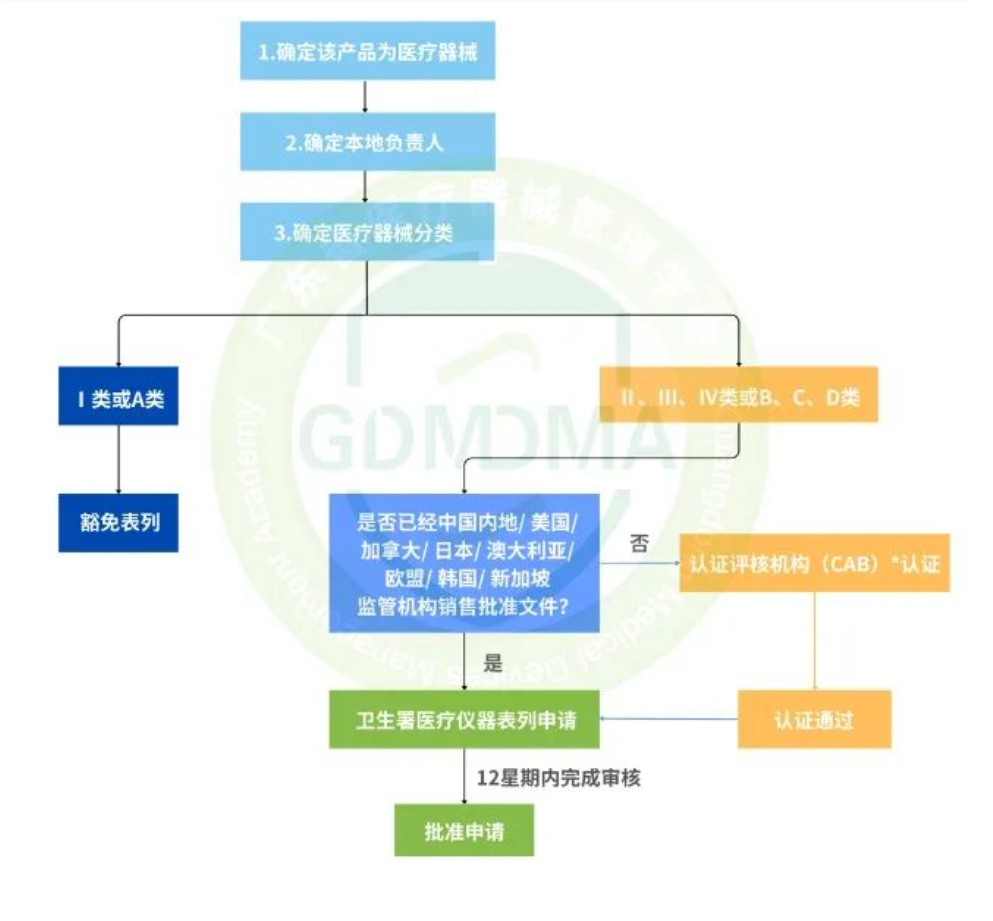
已有907次查看





