台湾医疗器械注册认证管理机构和制度、注册周期及费用中国台湾行政院卫生署食品药品管理局(衛生福利部食品藥物管理署Taiwan Food and Drug Administration,简称TFDA)负责台湾的医疗器械产品注册;台湾医疗器械注册需要遵循如下法规要求:
如涉及临床试验资料审核,费用另计;其中临床试验方案-新台币五万元,临床试验报告-新台币五万元,临床试验文件技术性评估-新台币两万元,临床试验变更审查-新台币五千元,海外临床试验机构现场核查-新台币六十五万元。
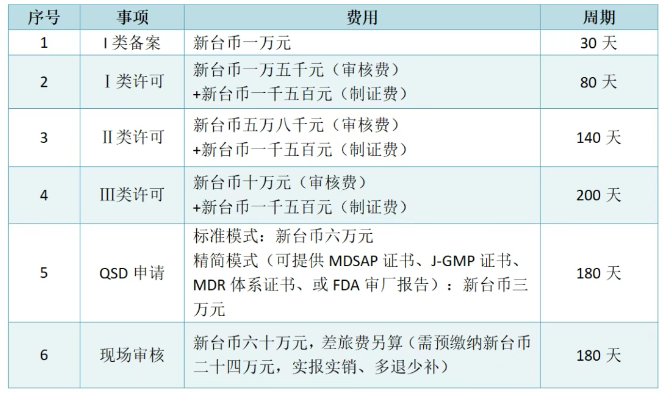
如涉及临床试验资料审核,费用另计;其中临床试验方案-新台币五万元,临床试验报告-新台币五万元,临床试验文件技术性评估-新台币两万元,临床试验变更审查-新台币五千元,海外临床试验机构现场核查-新台币六十五万元。
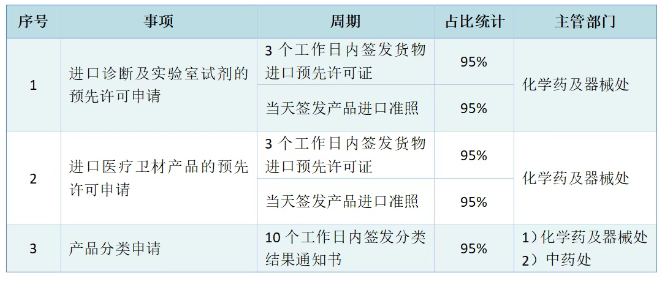
进口诊断及实验室试剂的预先许可申请,3个工作日内签发货物进口预先许可证,当天签发产品进口准照。

医疗仪器表列制度:医疗仪器制造商和进口商和分销商根据这个制度自愿向卫生署表列其医疗仪器;医疗事件呈报制度:制造商、进口商、使用者和公众通过这个制度,向卫生署报告有关医疗仪器的医疗事件,以便作出评估,防止医疗事件的重演。

申请资格
根据《公司条列》(第622章) 在香港成立;持有根据《商业登记条例》(第310章) 签发有效的商业登记证;并非政府资助机构; 以及并非任何政府资助机构的附属公司

申请资格
根据《公司条例》(第622章)在香港成立的公司或根据《商业登记条例》(第310章)在香港登记的企业;及非政府资助机构;及非政府资助机构的附属公司。

申请资格
申请公司须为根据《公司条例》(第622 章)于香港注册或根据《商业登记条例》(第310 章)于香港登记并正在香港进行研发活动的科技公司。

申请资格
根据《公司条例》(第622章)在香港注册成立;并非政府资助机构或政府资助机构的附属公司;承诺在核准资助范围内投入不少于2 亿元资金,按3个指定技术范畴(即生命健康科技、人工智能与数据科学,以及先进制造与新能源科 技)在香港设立新智能生产设施(即就每个申请项目而言,总项目成本最少为3亿元,企业须投入不少于2亿元资金);

申请资格
根据《公司条例》在香港注册成立的公司,并于截止申请日期成立不超过两年(适用于「原有计划」的申请者)或七年(适用于「延伸计划」的申请者)的公司


已有1376次查看

已有1218次查看
已有1196次查看
已有1179次查看

已有1176次查看

已有1207次查看

已有1222次查看
已有1195次查看
已有1208次查看

已有1119次查看





